Tinte en gel Gelite™ Safe se ha desarrollado específicamente para ser menos peligroso que EtBr para teñir ADN en geles de agarosa y acrilamida con una sensibilidad mucho mayor.
Descripción
Tinte en gel Gelite™ Safe DNA, Solución de agua 10,000X
AAT Bioquest se compromete a diseñar nuestros productos para que sean respetuosos con el medio ambiente. Es parte de cómo permitimos a nuestros clientes hacer que el mundo sea más saludable, más limpio y más seguro.
El bromuro de etidio (EtBr) se ha utilizado habitualmente como colorante de ADN durante muchos años. Sin embargo, el EtBr es perjudicial si se ingiere y muy tóxico si se inhala. Se ha demostrado que EtBr es mutagénico en varias pruebas y es una toxina acuática. SYBR® Safe se introdujo como una alternativa más segura a EtBr y SYBR® Green, pero desafortunadamente, es mucho menos sensible que SYBR® Green. Sólo tiene una sensibilidad comparable a la del EtBr.
Gelite™ Safe se ha desarrollado específicamente para ser menos peligroso que EtBr para teñir ADN en geles de agarosa y acrilamida con una sensibilidad mucho mayor. Gelite™ Safe ha mejorado enormemente la seguridad y la sensibilidad sin concesiones. La sensibilidad excepcional y la fuerte afinidad de unión al ADN de Gelite™ Safe permiten teñir el ADN antes o después de la electroforesis sin decolorar.
Además de sus propiedades de unión superiores, Gelite™ Safe es esencialmente no fluorescente en ausencia de ácidos nucleicos que muestran una fluorescencia de fondo muy baja. Al unirse a los ácidos nucleicos, Gelite™ Safe exhibe una mejora considerable de la fluorescencia de varios órdenes de magnitud mayor que la del EtBr. Gelite™ Safe se optimizó para ser compatible con varios instrumentos, incluidos transiluminadores UV y de luz azul, sistemas de documentación en gel y escáneres láser. Es la primera formulación única que se puede utilizar en el canal verde o rojo, según su preferencia.
A diferencia del SYBR® Green, permeable a la membrana, que es altamente tóxico para las células y el medio ambiente, las propiedades impermeables a la membrana de Gelite™ Safe lo convierten en una alternativa mucho más segura y no citotóxica. Además, las pruebas de Ames han confirmado que Gelite™ Safe es significativamente menos mutagénico que EtBr y SYBR® Green, incluso en concentraciones muy superiores a la concentración de trabajo utilizada para la tinción en gel.
La prueba de mutagenicidad de Ames se realizó de manera dependiente de la dosis para todos los colorantes de prueba pretratados con una fracción S9 de hígado de rata (SYBR® es una marca comercial de ThermoFisher).
Nombre en ingles: Gelite™ Safe DNA Gel Stain *10,000X Water Solution*
| Catalogo | Producto | Presentación |
|---|---|---|
| AAT-17700 | Tinte en gel Gelite™ Safe DNA Solución de agua 10,000X | 100 ul |
| AAT-17701 | Tinte en gel Gelite™ Safe DNA Solución de agua 10,000X | 500 ul |
| AAT-17702 | Tinte en gel Gelite™ Safe DNA Solución de agua 10,000X | 1 ml |
| AAT-17703 | Tinte en gel Gelite™ Safe DNA Solución de agua 10,000X | 10 ml |
Importante: Solo para uso en investigación (RUO). Almacenamiento: Temperatura ambiente (10-25 °C); Minimizar la exposición a la luz.
Plataforma
Generador de imágenes en gel
| Excitación | UV Transiluminador/Blue laser |
| Emisión | SYBR® filter, GelStar® filter, GelGreen® filter, o GelRed® filter |
Preparación de Solución de Trabajo
Gelite™ Safe
Prepare una solución de trabajo 1X Gelite™ Safe diluyendo el reactivo madre 10.000X con un buffer de su elección en un rango de pH de 7,5 a 8,5 (por ejemplo, TAE, TBE o TE, preferiblemente pH 8,2).
Nota: Las soluciones de tinción preparadas en agua son menos estables que las preparadas en buffer y deben usarse dentro de las 24 horas para garantizar la máxima sensibilidad a la tinción.
Espectro
Abrir en Advanced Spectrum Viewer
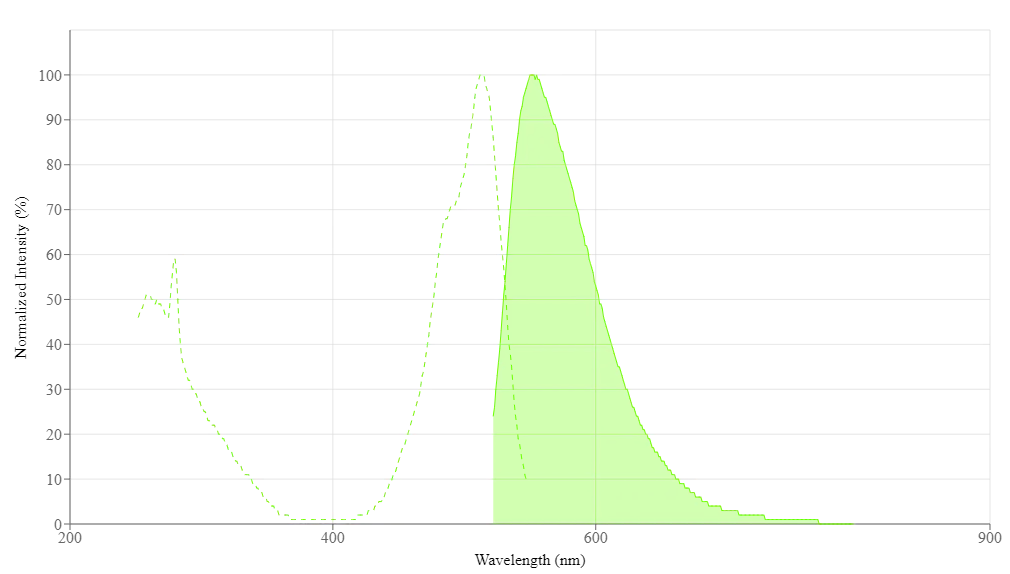
Propiedades espectrales
| Excitación (nm) | 509 |
| Emisión (nm) | 552 |
| Absorbancia | 509 |
Imagen
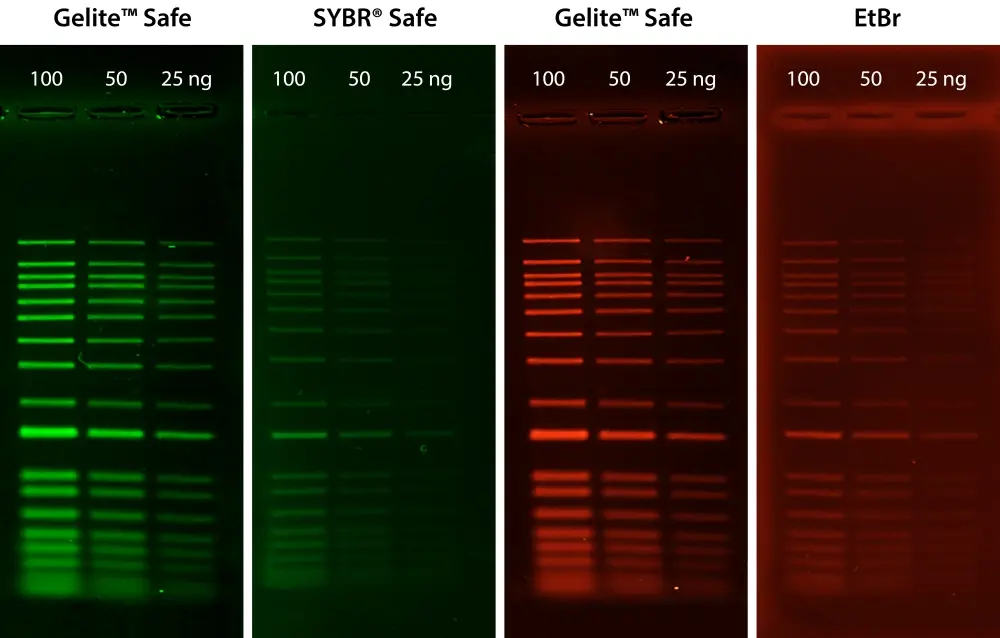
Figura 1. Comparación de la detección de ADN en gel de agarosa al 1 % en tampón TBE utilizando Gelite™ Safe, EtBr y SYBR® Safe. Se cargaron diluciones en serie dobles de escalera de ADN de 1 kb en cantidades de 100 ng, 50 ng y 25 ng de izquierda a derecha. Los geles se tiñeron durante 60 minutos con Gelite™ Safe, EtBr y SYBR® Safe según las concentraciones recomendadas por el fabricante y se tomaron imágenes utilizando el sistema de imágenes ChemiDoc™ (Bio-Rad®). Los geles se iluminaron utilizando un transiluminador de 300 nm equipado con un filtro GelGreen.
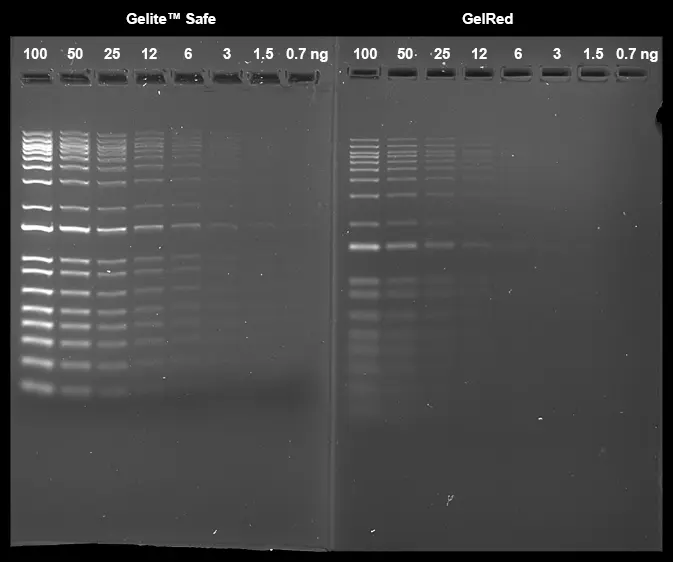
Figura 2. Comparación de Gelite™ Safe (dilución 1:25.000X) y GelRed® (dilución 1:10.000X) en tinción de gel prefabricado utilizando gel de agarosa al 1 % en buffer TBE. Se cargaron diluciones en serie dobles de escalera de ADN de 1 kb en cantidades de 100 ng, 50 ng, 25 ng, 12 ng, 6 ng, 3 ng, 1,5 ng y 0,7 ng de izquierda a derecha. Se tomaron imágenes de los geles utilizando un transiluminador de 300 nm en ChemiDoc™ Imaging System (Bio-Rad®).
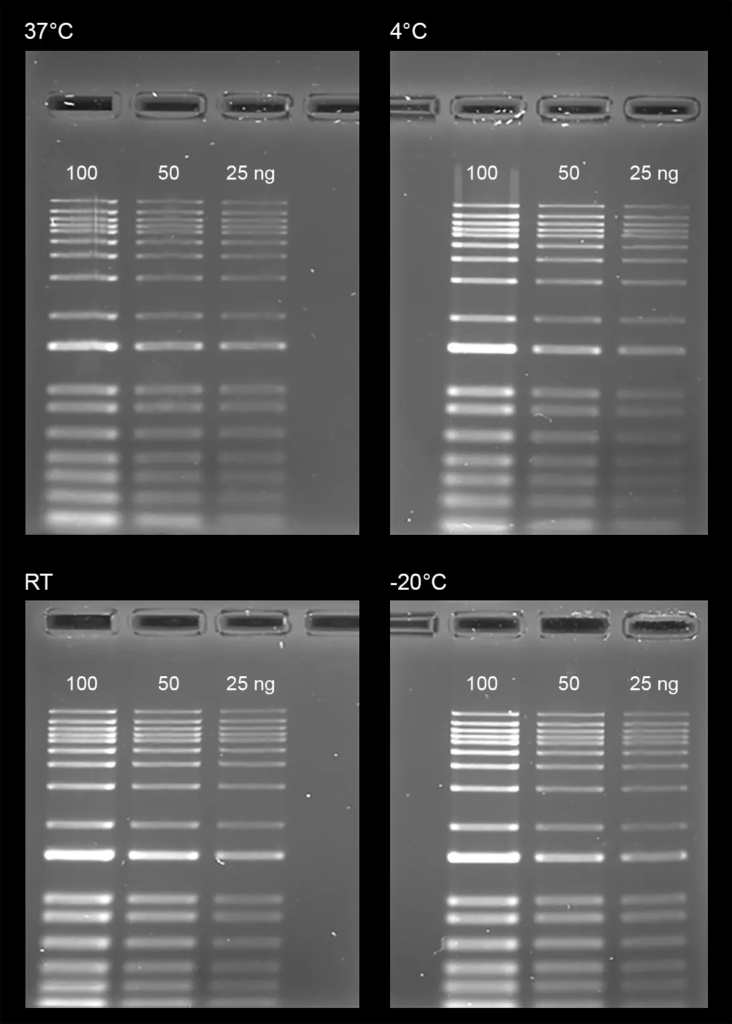
Figura 3. Prueba de estabilidad de Gelite™ Safe DNA Gel Stain, que se disolvió en agua y se almacenó a cuatro temperaturas diferentes (-20 °C, 4 °C, temperatura ambiente y 37 °C) durante un período de un mes. Después del almacenamiento, las escaleras de ADN (100, 50 y 25 ng) se cargaron en gel de agarosa al 1 % durante 60 minutos a 75 V. Los geles se incubaron con Gelite™ Safe DNA Gel Stain durante 1 hora. La imagen fue capturada con el conjunto de filtros verdes SYBR (tiempo de exposición = 1.5 segundos).
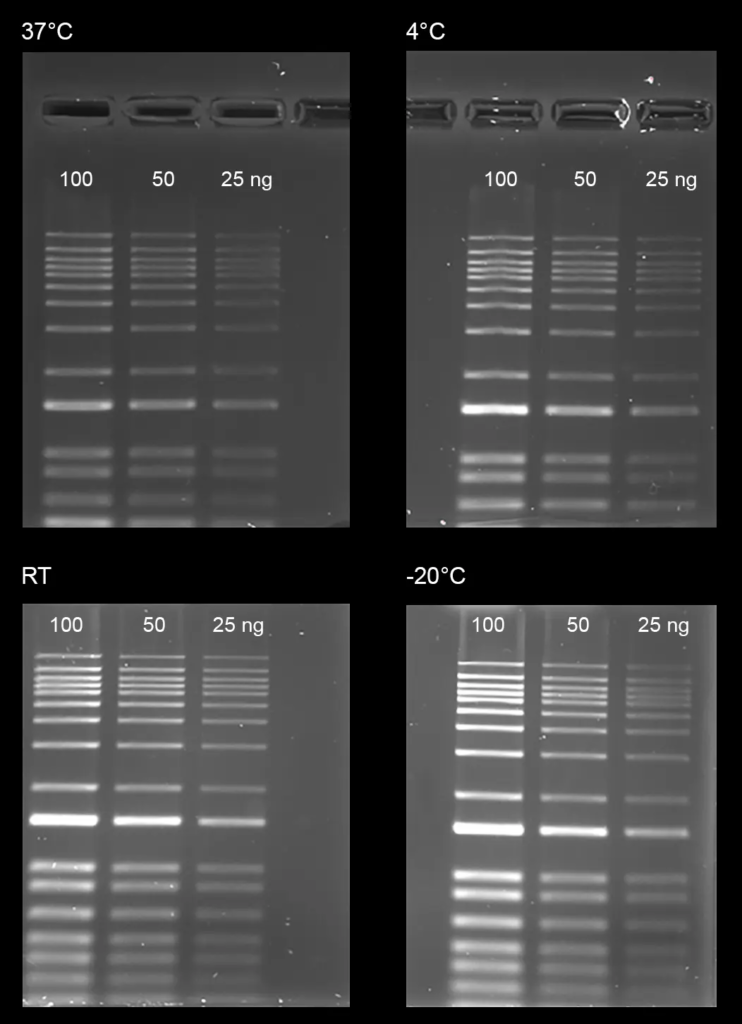
Figura 4. Prueba de estabilidad de Gelite™ Safe DNA Gel Stain, que se disolvió en agua y se almacenó a cuatro temperaturas diferentes (-20 °C, 4 °C, temperatura ambiente y 37 °C) durante un período de tres meses. Después del almacenamiento, las escaleras de ADN (100, 50 y 25 ng) se cargaron en gel de agarosa al 1 % durante 60 minutos a 75 V. Los geles se incubaron con Gelite™ Safe DNA Gel Stain durante 1 hora. La imagen fue capturada con el conjunto de filtros verdes SYBR (tiempo de exposición = 1,5 segundos).
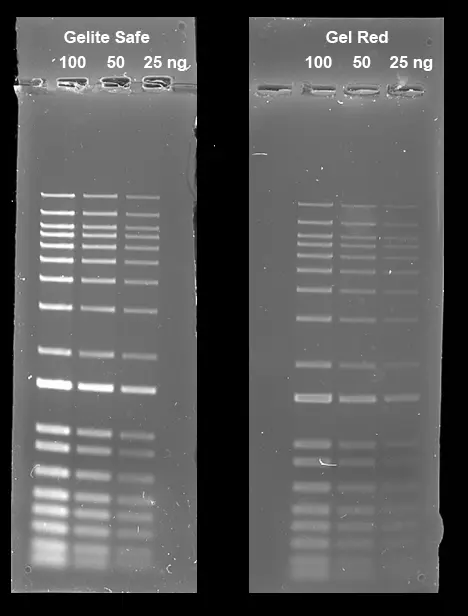
Figura 5. Comparación de la detección de ADN en gel de agarosa al 1% en tampón TBE usando Gelite™ Safe y GelRed®. Se cargaron diluciones en serie dobles de escalera de ADN de 1 kb en cantidades de 100 ng, 50 ng y 25 ng de izquierda a derecha. Los geles se tiñeron durante 60 minutos con Gelite™ Safe y GelRed™ (Biotium) según las concentraciones recomendadas por el fabricante y se tomaron imágenes utilizando el sistema de imágenes ChemiDoc™ (Bio-Rad®). Los geles se iluminaron utilizando un transiluminador de 300 nm equipado con un juego de filtros EtBr.
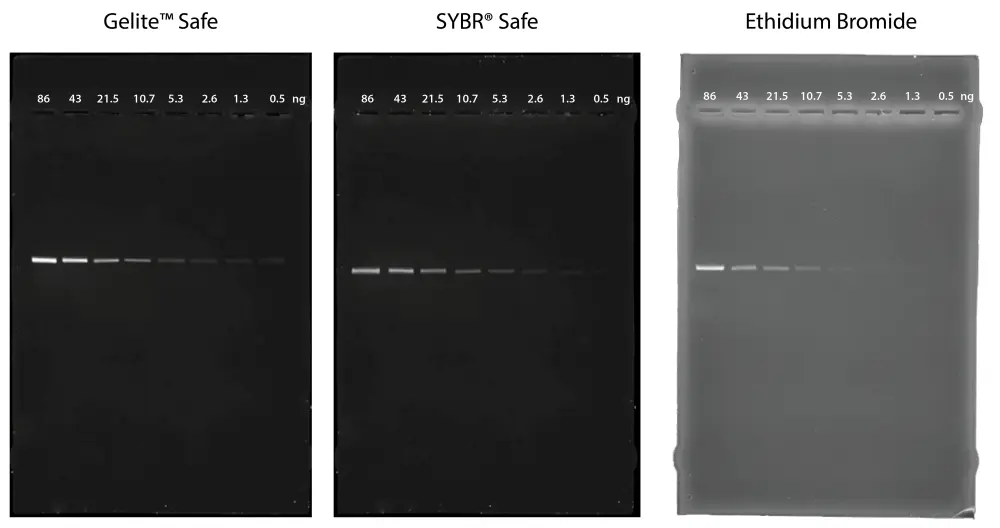
Figura 6. Comparación de la detección de ADN en gel de agarosa al 1 % en buffer TBE utilizando Gelite™ Safe, SYBR® Safe y EtBr. Se cargaron diluciones en serie dobles de escalera de ADN de 1 kb en cantidades de 86 ng, 43 ng, 21,5 ng, 10,7 ng, 5,3 ng, 2,6 ng, 1,3 ng y 0,5 ng de izquierda a derecha. Se tomaron imágenes de los geles utilizando un transiluminador de 300 nm en ChemiDoc™ Imaging System (Bio-Rad®).
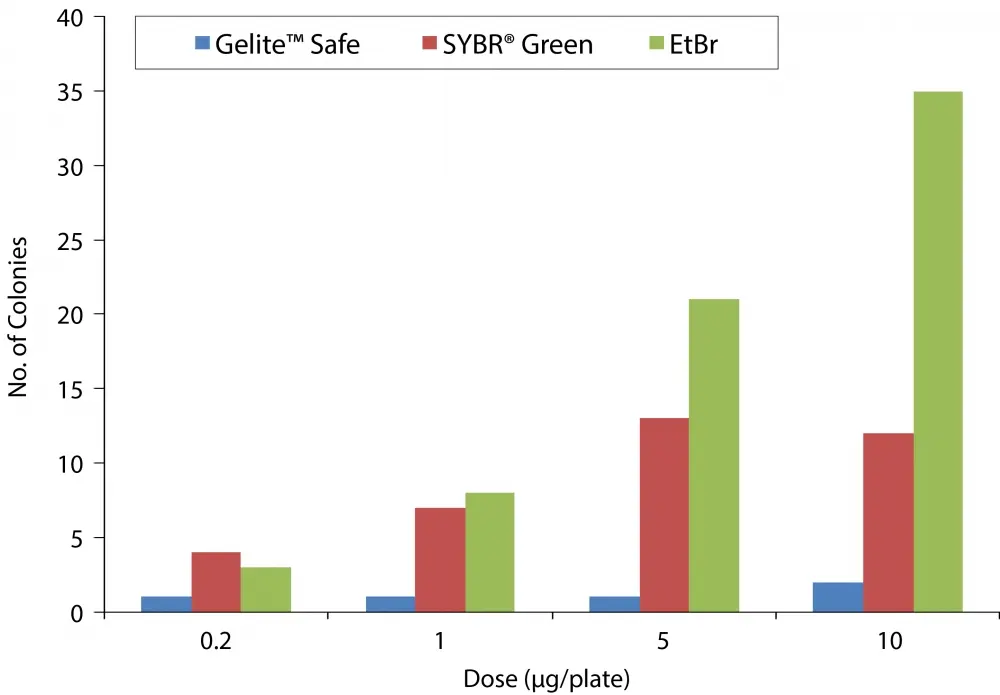
Figura 7. Resumen de los resultados de la prueba de Ames. La prueba de mutagenicidad de Ames se realizó de manera dependiente de la dosis para Gelite™ Safe, SYBR® Green y EtBr. Las muestras se trataron previamente con un extracto de hígado de fracción S9 y luego se analizaron. Con la cepa TA1538 de S. Typhimurium, un aumento en los revertidos de más del doble con respecto al fondo indica un resultado positivo de mutagenicidad.
Formatos Alternativos
Productos Relacionados
Referencias
Ver todas las 47 referencias: Citation Explorer
Limited Proteolysis and Gel Electrophoresis in the Presence of Metal Cations: Au(III)-binding Luminescent Domain in Serum Albumins.
Authors: Dixon, Jacob M and Egusa, Shunji
Journal: Journal of visualized experiments : JoVE (2021)
High affinity of AS1411 toward copper; its application in a sensitive aptasensor for copper detection.
Authors: Bahreyni, Amirhossein and Ramezani, Mohammad and Alibolandi, Mona and Hassanzadeh, Pirooz and Abnous, Khalil and Taghdisi, Seyed Mohammad
Journal: Analytical biochemistry (2019): 1-9
Transfection Studies with Colloidal Systems Containing Highly Purified Bipolar Tetraether Lipids from Sulfolobus acidocaldarius.
Authors: Engelhardt, Konrad H and Pinnapireddy, Shashank Reddy and Baghdan, Elias and Jedelská, Jarmila and Bakowsky, Udo
Journal: Archaea (Vancouver, B.C.) (2017): 8047149
Metallo-supramolecular gels based on a multitopic cyclam bis-terpyridine platform.
Authors: Gasnier, Aurélien and Royal, Guy and Terech, Pierre
Journal: Langmuir : the ACS journal of surfaces and colloids (2009): 8751-62
[Cloning of group A streptococcal pyrogenic exotoxin-B gene and its recombinant protein expression in culture supernatant].
Authors: Watanabe, Y
Journal: Journal of Nippon Medical School = Nippon Ika Daigaku zasshi (2001): 222-32
Characterization of hepatic L-threonine dehydrogenase of chicken.
Authors: Yuan, J H and Austic, R E
Journal: Comparative biochemistry and physiology. Part B, Biochemistry & molecular biology (2001): 65-73
Purification and characterization of chondroitin 4-sulfotransferase from the culture medium of a rat chondrosarcoma cell line.
Authors: Yamauchi, S and Hirahara, Y and Usui, H and Takeda, Y and Hoshino, M and Fukuta, M and Kimura, J H and Habuchi, O
Journal: The Journal of biological chemistry (1999): 2456-63
Comparison of tube and gel red blood cell agglutination techniques in detecting chimeras after major ABO-mismatched allogeneic hematopoietic stem cell transplantation.
Authors: Kupferman, M J and Cipolone, K M and Procter, J L and Stroncek, D F
Journal: Immunohematology (1998): 63-7
Expression of pig heart mitochondrial NADP-dependent isocitrate dehydrogenase in Escherichia coli.
Authors: Soundar, S and Jennings, G T and McAlister-Henn, L and Colman, R F
Journal: Protein expression and purification (1996): 305-12
Purification of acid sphingomyelinase from human placenta: characterization and N-terminal sequence.
Authors: Lansmann, S and Ferlinz, K and Hurwitz, R and Bartelsen, O and Glombitza, G and Sandhoff, K
Journal: FEBS letters (1996): 227-31
Bibliografia
BioAI for Anti-Infective Drug Discovery
Authors: Esquivel, Maria and Fernando, Johann and Fisher, Anna and Leong, Cameron and Weaver, Adam
Journal: (2022)
Referencias
Ver todas las 53 referencias: Citation Explorer
A flow cytometric comparison of Indo-1 to fluo-3 and Fura Red excited with low power lasers for detecting Ca(2+) flux
Authors: Bailey S, Macardle PJ.
Journal: J Immunol Methods (2006): 220
Functional fluo-3/AM assay on P-glycoprotein transport activity in L1210/VCR cells by confocal microscopy
Authors: Orlicky J, Sulova Z, Dovinova I, Fiala R, Zahradnikova A, Jr., Breier A.
Journal: Gen Physiol Biophys (2004): 357
Comparison of human recombinant adenosine A2B receptor function assessed by Fluo-3-AM fluorometry and microphysiometry
Authors: Patel H, Porter RH, Palmer AM, Croucher MJ.
Journal: Br J Pharmacol (2003): 671
Measurement of the dissociation constant of Fluo-3 for Ca2+ in isolated rabbit cardiomyocytes using Ca2+ wave characteristics
Authors: Loughrey CM, MacEachern KE, Cooper J, Smith GL.
Journal: Cell Calcium (2003): 1
A sensitive method for the detection of foot and mouth disease virus by in situ hybridisation using biotin-labelled oligodeoxynucleotides and tyramide signal amplification
Authors: Zhang Z, Kitching P.
Journal: J Virol Methods (2000): 187
Kinetics of onset of mouse sperm acrosome reaction induced by solubilized zona pellucida: fluorimetric determination of loss of pH gradient between acrosomal lumen and medium monitored by dapoxyl (2-aminoethyl) sulfonamide and of intracellular Ca(2+) chang
Authors: Rockwell PL, Storey BT.
Journal: Mol Reprod Dev (2000): 335
MRP2, a human conjugate export pump, is present and transports fluo 3 into apical vacuoles of Hep G2 cells
Authors: Cantz T, Nies AT, Brom M, Hofmann AF, Keppler D.
Journal: Am J Physiol Gastrointest Liver Physiol (2000): G522
Use of co-loaded Fluo-3 and Fura Red fluorescent indicators for studying the cytosolic Ca(2+)concentrations distribution in living plant tissue
Authors: Walczysko P, Wagner E, Albrechtova JT.
Journal: Cell Calcium (2000): 23
[Ca2+]i following extrasystoles in guinea-pig trabeculae microinjected with fluo-3 – a comparison with frog skeletal muscle fibres
Authors: Wohlfart B., undefined
Journal: Acta Physiol Scand (2000): 1
Determination of the intracellular dissociation constant, K(D), of the fluo-3. Ca(2+) complex in mouse sperm for use in estimating intracellular Ca(2+) concentrations
Authors: Rockwell PL, Storey BT.
Journal: Mol Reprod Dev (1999): 418
Aplication Notes
Considerations of Preparing Gel Electrophoresis Procedures
Experimental Protocol for DNA Agarose Gel Electrophoresis
A Novel Fluorescent Probe for Imaging and Detecting Hydroxyl Radical in Living Cells
Abbreviation of Common Chemical Compounds Related to Peptides
Annexin V
FAQ
Are there any alternatives for ethidium bromide in agarose gels?
Does RNA polymerase make RNA?
How does ethidium bromide work?
How does RNA polymerase work?
Is DNA an organelle?
AssayWise
A Practical Guide for the Detection and Analysis of PCR Products
Glycerol 3-Phosphate Assays
Nucleic Acid Quantification
Hydroxyl Radical Detection
Thiol Detection


