Transfectamine™ 5000 Transfection Reagent. Se puede utilizar para la transfección de ADN plasmídico.
Descripción
El reactivo de transfección Transfectamine™ 5000 es un reactivo de transfección potente y versátil para la introducción de ácidos nucleicos en células eucariotas o, más específicamente, en células animales. Puede transfectar eficazmente una variedad de cargas útiles en una variedad de líneas celulares adherentes y de suspensión.
Se puede utilizar para la transfección de ADN plasmídico, así como para experimentos de eliminación de genes basados en siRNA y shRNA y estudios de expresión génica. Ofrece una alta eficiencia de transfección constante en una amplia variedad de líneas celulares adherentes y en suspensión, incluidas las células difíciles de transfectar. La baja toxicidad de Transfectamine™ 5000 también permite una mayor viabilidad de las células transfectadas.
Transfectamine™ 5000 es más fácil de usar en comparación con la mayoría de los otros reactivos de transfección y no requiere un medio especial.
| Catalogo | Producto | Presentación |
|---|---|---|
| AAT-60020 | Transfectamine™ 5000 Transfection Reagent | 0.5 ml |
| AAT-60021 | Transfectamine™ 5000 Transfection Reagent | 1 ml |
| AAT-60022 | Transfectamine™ 5000 Transfection Reagent | 5 ml |
Importante: Solo para uso en investigación (RUO). Almacenamiento: Congelación (< -15 °C). Minimizar la exposición a la luz.
Preparación de la solución de trabajo
- Mesclar 2.5 ug de DNA con 200 uL de medio libre de suero.
- Añadir 7.5 uL de Transfectamine™ 5000 al paso 1.
- Mescalr bien e incubar a temperatura ambiente por 20 minutos. Nota: La proporción de Transfectamine™ 5000 y ADN debe optimizarse para diferentes líneas celulares, en general: Reactivo de transfección Transfection™ 5000 (uL) por ADN (ug) Proporción = 3 – 5 uL por 1ug
Protocolo de muestra para microplacas de 6 pozos de 10cm.
| Componente | 6 well plate (por pozo) | 10 cm plate |
| Fresh culture medium | 2 mL | 6 mL |
| Plasmid | ~2.5 ug | 7.5~10 ug |
| Serum-free medium | 200 uL | 600 uL |
| Transfectamine™ 5000 Transfection Reagent | ~7.5 uL | ~22.5 uL |
Imagenes
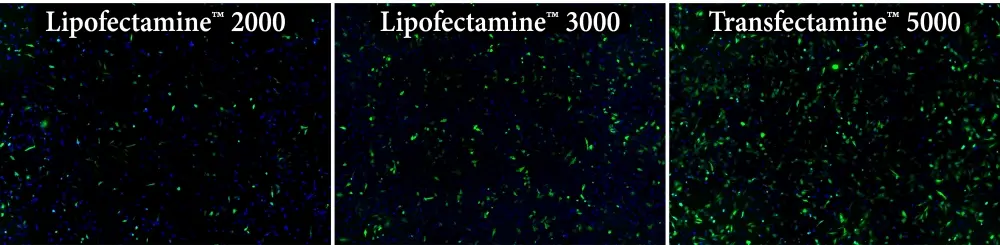
Figura 1. Comparación de la eficiencia de transfección en células HeLa utilizando los reactivos Transfectamine™ 5000, Lipofectamine 2000 y Lipofectamine 3000. Cada reactivo se utilizó para transfectar células HeLa en un formato de 96 pocillos y la expresión de GFP se analizó 24 horas después de la transfección. El reactivo de transfección Transfectamine™ 5000 proporcionó una mayor eficiencia de transfección GFP en comparación con los reactivos Lipofectamine 2000 y Lipofectamine 3000.
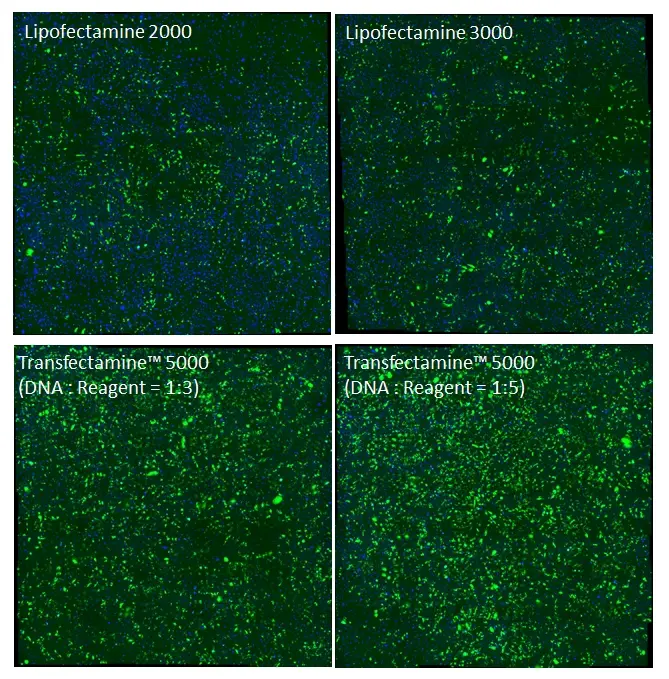
Figura 2. Comparación de eficiencia de transfección en células CHO-K1. Las células CHO-K1 se cultivaron en una placa de 6 pocillos hasta una confluencia de ~90 %. Se transfectaron 2,5 ug de plásmido GFP con Lipofectamine 2000, Lipofectamine 3000 y Transfectamine™ 5000. Se tomaron imágenes 24 horas después de la transfección con microscopio fluorescente a través del canal FITC.

Figura 3. Comparación de viabilidad celular en células CHO-K1. Un grupo de células CHO K1 se transfectaron con plásmido GFP usando Lipofectamine 2000, Lipofectamine 3000 y Transfectamine™ 5000, el segundo grupo de células CHO K1 se trató con la misma cantidad de reactivo de transfección que el primer grupo pero sin plásmido. Después de 48 horas, se midió la viabilidad celular de cada grupo con el kit de cuantificación de células Cell Meter™ Colorimetric WST-8 (Cat. 22770). La mayor absorbancia a 460 nm representa células más viables.

Figura 4. Comparación de eficiencia de transfección en células HeLa. Las células HeLa se cultivaron en una placa de 6 pocillos hasta una confluencia del 90%. Se transfectaron 2.5 µg de plásmido GFP con Lipofectamine 2000, Lipofectamine 3000 y Transfectamine™ 5000. La intensidad de la señal se midió mediante citometría de flujo.
Bibliografía
Ver todas las 45 bibliografias: Citation Explorer
Discovery of paralogous GnRH and corazonin signaling systems in an invertebrate chordate
Authors: Yanez-Guerra, Luis Alfonso and Zandawala, Meet
Journal: bioRxiv (2023): 2023–03
SINE Insertion in the Intron of Pig GHR May Decrease Its Expression by Acting as a Repressor
Authors: Chen Cai, and Zheng, Yao and Wang Mengli, and Murani, Eduard and D’Alessandro, Enrico and Moawad, Ali Shoaib and Wang, Xiaoyan and Wimmers, Klaus and Song, Chengyi
Journal: Animals (2021): 1871
A Powerful Transfection Reagent for Building Stable GPCR Expressing Cell Lines
Authors: Kan, Shu and Liao, Jinfang and Diwu, Zhenjun
Journal: Biophysical Journal (2020): 564a–565a
Lipofectamine 2000/siRNA complexes cause endoplasmic reticulum unfolded protein response in human endothelial cells
Authors: Li, Z., Zhang, C., Wang, Z., Shen, J., Xiang, P., Chen, X., Nan, J., Lin, Y.
Journal: J Cell Physiol (2019): 21166-21181
Transfection reagent Lipofectamine triggers type I interferon signaling activation in macrophages
Authors: Guo, X., Wang, H., Li, Y., Leng, X., Huang, W., Ma, Y., Xu, T., Qi, X.
Journal: Immunol Cell Biol (2019): 92-96
Comparison between Lipofectamine RNAiMAX and GenMute transfection agents in two cellular models of human hepatoma
Authors: Berardo, C., Siciliano, V., Di Pasqua, L. G., Richelmi, P., Vairetti, M., Ferrigno, A.
Journal: Eur J Histochem (2019): ersion=”1.0″ encoding=”UTF-8″ ?>60200.enlEndN
Correction to: Nematollahi et al., Ternary complex of plasmid DNA with NLS-Mu-Mu protein and cationic niosome for biocompatible and efficient gene delivery: a comparative study with protamine and lipofectamine
Authors: name=”60200.enl” path=”C:\Users\aatbi\Dropbox (AAT Bioquest)\Website Working Files\Product References\60200.enl”>60200.enlEndNote4417Correction to: Nematollahi et al., Ternary complex of plasmid DNA with NLS-Mu-Mu protein and cationic niosome for biocompatible , undefined and efficient gene delivery: a comparative study with protamine , undefined and lipofectamineArtif Cells Nanomed BiotechnolArtif Cells Nanomed Biotechnol19924682017/12/062018Dec2169-141X (Electronic)
2169-1401 (Linking)29205060eng
Published Erratum
Engl, undefined and 
Artif Cells Nanomed Biotechnol. 2018 Dec;46(8):1992. doi: 10.1080/21691401.2017.1405231. Epub 2017 Dec 5.https://www.ncbi.nlm.nih.gov/pubmed/2920506010.1080/21691401.2017.1405231</electronic-reso, undefined
Journal: Artif Cells Nanomed Biotechnol (2018): 1992
Ternary complex of plasmid DNA with NLS-Mu-Mu protein and cationic niosome for biocompatible and efficient gene delivery: a comparative study with protamine and lipofectamine
Authors: Nematollahi, M. H., Torkzadeh-Mahanai, M., Pardakhty, A., Ebrahimi Meim and , H. A., Asadikaram, G.
Journal: Artif Cells Nanomed Biotechnol (2018): 1781-1791
The vector-related influences of autophagic microRNA delivery by Lipofectamine 2000 and polyethylenimine 25K on mouse embryonic fibroblast cells
Authors: Lin, C. W., Jan, M. S., Kuo, J. S.
Journal: Eur J Pharm Sci (2017): 11-21
The Utilization of RNA Silencing Technology to Mitigate the Voriconazole Resistance of Aspergillus Flavus; Lipofectamine-Based Delivery
Authors: Nami, S., Baradaran, B., Mansoori, B., Kordbacheh, P., Rezaie, S., Falahati, M., Mohamed Khosroshahi, L., Safara, M., Zaini, F.
Journal: Adv Pharm Bull (2017): 53-59
FAQ
Do you have a suggested protocol for cell transfection?
How does a transfection reagent work?
How do I optimize my reverse transcription process?
How does RNA polymerase II work?
How does RNA polymerase work?
AssayWise
Transfectamine 5000: an efficient and reliable DNA delivery system


