Kit de ensayo de peroxinitrito intracelular fluorimétrico Cell Meter™ de Fluorescencia verde. AAT Bioquest ha desarrollado DAX-J2™ PON Green, herramienta sensible para monitorear el nivel de peroxinitrito (ONOO-) en células vivas.
Descripción
El peroxinitrito (ONOO-) es una especie oxidante fuerte y un agente nitrante muy activo. El peroxinitrito se forma a partir de la reacción entre los radicales superóxido y el óxido nítrico generado en las células. Puede causar daños a una amplia gama de biomoléculas, incluidas proteínas, enzimas, lípidos y ácidos nucleicos, lo que eventualmente contribuye a la muerte celular. Mientras tanto, el peroxinitrito también puede tener actividades protectoras in vivo al contribuir a las respuestas de defensa del huésped contra los patógenos invasores.
Por lo tanto, el peroxinitrito es un oxidante biológico esencial involucrado en una amplia gama de procesos fisiológicos y patológicos. Debido a su vida media extremadamente corta y su baja concentración en estado estacionario, ha sido un desafío detectar y comprender el papel del peroxinitrito en los sistemas biológicos. El DAX-J2™ PON Green de AAT Bioquest se ha desarrollado para abordar esta necesidad insatisfecha. Proporciona una herramienta sensible para monitorear el nivel de ONOO en células vivas. DAX-J2™ PON Green de AAT Bioquest reacciona específicamente con ONOO- intercelular para generar un producto fluorescente de color verde brillante. Se puede utilizar en análisis de imágenes de fluorescencia, citometría de flujo y lectores de microplacas de fluorescencia.
Nombre en Ingles: Cell Meter™ Fluorimetric Intracellular Peroxynitrite Assay Kit *Green Fluorescence*
| Catalogo | Producto | Presentación |
|---|---|---|
| AAT-16315 | Kit de Ensayo de peroxinitrito intracelular fluorimétrico Cell Meter™ Fluorescencia Verd | 100 pruebas |
Importante: Solo para uso en investigación (RUO).
Plataforma
Microscopio de Fluorescencia
| Excitación | 490 nm |
| Emisión | 530 nm |
| Placa recomendada | Pared negra / fondo claro |
| Especificaciones instrumento | Juego de filtro FITC |
Lector de microplacas de Fluorescencia
| Excitación | 490 nm |
| Emisión | 530 nm |
| Cutoff | 515 nm |
| Placa recomendada | Pared negra / fondo claro |
| Especificaciones Instrumento | Modo de lectura inferior |
Componentes
| Componente A: DAX-J2™ PON Green | 1 vial |
| Componente B: Buffer de ensayo | 1 vial (1 mL/vial) |
| Componente C: DMSO | 1 vial (100 µL/vial) |
PREPARACION DE SOLUCION DE STOCK
A menos que se indique lo contrario, todas las soluciones madre no utilizadas deben dividirse en alícuotas de un solo uso y almacenarse a -20 °C después de la preparación. Evite los ciclos repetidos de congelación y descongelación.
Solución madre DAX-J2™ PON Green (500X):
Agregue 20 µL de DMSO (Componente C) en el vial de DAX-J2™ PON Green (Componente A) y mezcle bien. Nota: 20 µL de solución madre de DAX-J2™ PON Green reconstituida es suficiente para 1 placa.
PREPARACION DE SOLUCION DE TRABAJO
Agregue 10 μL de solución madre del sensor de peroxinitrito DAX-J2™ reconstituido con DMSO 500X en 500 μL de buffer de ensayo (componente B) y mezcle bien. Nota: La solución de trabajo no es estable; prepárelo según sea necesario antes de usarlo.
Para guia sobre la preparación de muestras de células, visite:
https://www.aatbio.com/resources/guides/cell-sample-preparation.html
Imagenes
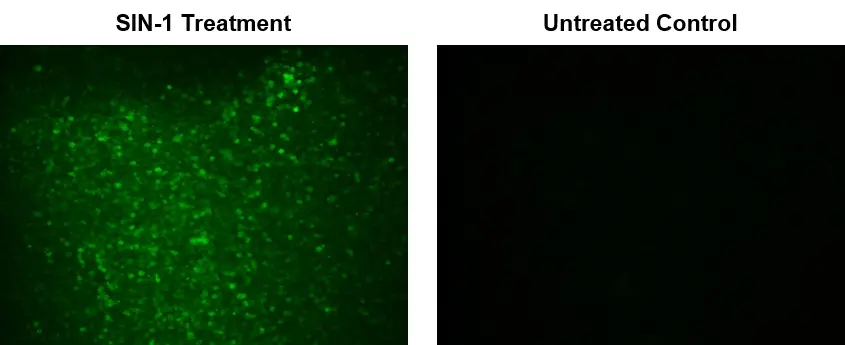
Figura 1. Imágenes de fluorescencia de peroxinitrito intracelular en células macrófagas RAW 264.7 utilizando el kit de ensayo de peroxinitrito intracelular fluorimétrico Cell Meter™ (n.° de cat. 16315). Se sembraron células 264.7 sin procesar a 100.000 células/pocillo/100 µl durante la noche en una placa de 96 pocillos de pared negra/fondo transparente Costar. Tratamiento SIN-1: las células se coincubaron con DAX-J2™ PON Green y SIN-1 100 µM a 37 °C durante 1 hora. Control sin tratar: las células RAW 264.7 se incubaron con DAX-J2™ PON Green sin tratamiento con SIN-1. Las señales de fluorescencia se midieron utilizando un microscopio de fluorescencia con un filtro FITC
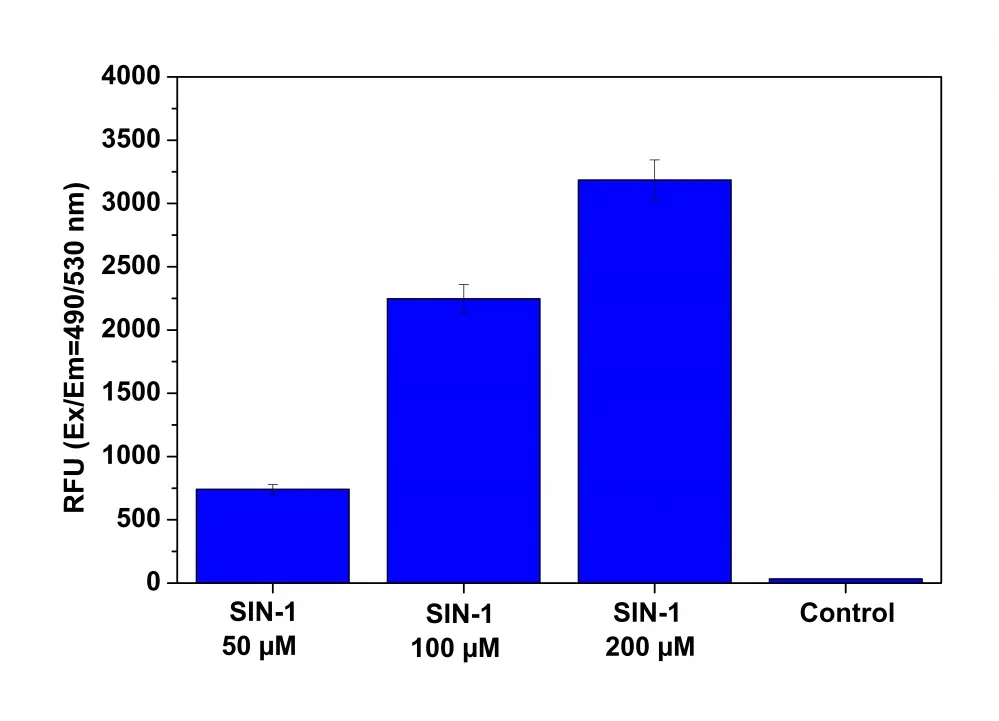
Figura 2. Detección de peroxinitrito en células vivas tras el tratamiento con SIN-1 utilizando el kit de ensayo de peroxinitrito intracelular fluorimétrico Cell Meter™ (n.° de catálogo 16315). Se sembraron células RAW 264.7 a 100.000 células/pocillo/100 µl durante la noche en una placa de 96 pocillos Costar de pared negra/fondo transparente. Las células se coincubaron con la solución de trabajo DAX-J2™ PON Green y SIN-1 a una concentración de 50 a 200 µM a 37 ºC durante 1 hora. Las células incubadas con DAX-J2™ PON Green sin tratamiento con SIN-1 se usaron como control. La señal de fluorescencia se controló a Ex/Em = 490/530 nm (corte = 515 nm) con modo de lectura inferior utilizando un lector de microplacas FlexStation (Molecular Devices).
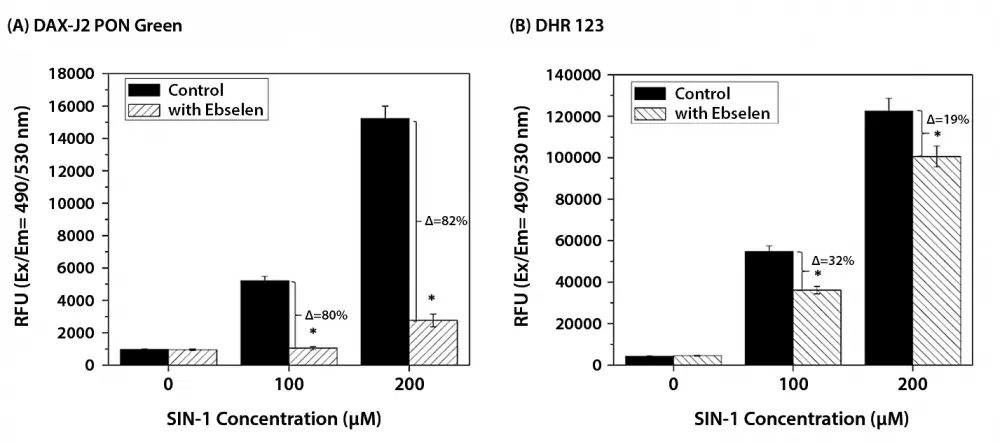
Figura 3. Medición del lector de microplacas de células RAW 264.7 marcadas con (A) DAX-J2 PON Green o (B) DHR 123. Las células RAW 264.7 se trataron con diferentes concentraciones de SIN-1. Se usó Ebselen a una concentración de 20 µM como eliminador de ONOO. En comparación con DHR 123, el ebselen inhibió más completamente el aumento de la fluorescencia de las células marcadas con DAX-J2 PON Green tras el tratamiento con SIN-1. Como en hallazgos anteriores, la oxidación de DHR 123 en cualquier tipo de célula puede involucrar no solo a ONOO- sino también a otras ROS/RNS relacionadas. Estos resultados resaltan aún más la alta selectividad de DAX-J2 PON Green para la detección de ONOO intracelular.
Productos Relacionados
| Nombre |
| Cell Meter™ Fluorimetric Intracellular pH Assay Kit |
| Cell Meter™ Fluorimetric Intracellular Peroxynitrite Assay Kit *Optimized for Flow Cytometry* |
| Cell Meter™ Fluorimetric Cell Cytotoxicity Assay Kit |
| Cell Meter™ Cell Viability Assay Kit *Red Fluorescence* |
Bibliografía
Triterpenoids and ultrasound dual-catalytic nanoreactor ignites long-lived hypertoxic reactive species storm for deep tumor treatment
Authors: Li, Ziying and Xie, Huanzhang and Shi, Huifang and Li, Dongmiao and Zhang, Zizhong and Chen, Haijun and Gao, Yu
Journal: Chemical Engineering Journal (2023): 139938
Interactions between pH, reactive species, and cells in plasma-activated water can remove algae
Authors: Mizoi, Ken and Rodr{\’\i}guez-Gonz{\’a}lez, Vicente and Sasaki, Mao and Suzuki, Shoki and Honda, Kaede and Ishida, Naoya and Suzuki, Norihiro and Kuchitsu, Kazuyuki and Kondo, Takeshi and Yuasa, Makoto and others,
Journal: RSC advances (2022): 7626–7634
Mechanisms of oxidative removal of 1, 4-dioxane via free chlorine rapidly mixing into monochloramine: Implications on water treatment and reuse
Authors: Wu, Liang and Patton, Samuel D and Liu, Haizhou
Journal: Journal of Hazardous Materials (2022): 129760
Peroxynitrite (ONOO-) generation from the HA-TPP@ NORM nanoparticles based on synergistic interactions between nitric oxide and photodynamic therapies for elevating anticancer efficiency
Authors: Jiang, Dawei and Yue, Tao and Wang, Guichen and Wang, Chaochao and Chen, Chao and Cao, Hongliang and Gao, Yun
Journal: New Journal of Chemistry (2020): 162–170
Nitric oxide and reactive oxygen species-releasing polylactic acid monolith for enhanced photothermal therapy of osteosarcoma
Authors: Lee, Ji-Hye and Uyama, Hiroshi and Kwon, Oh-Kyoung and Kim, Young-Jin
Journal: Journal of Industrial and Engineering Chemistry (2020)
Fluorescent real-time quantitative measurements of intracellular peroxynitrite generation and inhibition
Authors: Luo, Zhen and Zhao, Qin and Liu, Jixiang and Liao, Jinfang and Peng, Ruogu and Xi, Yunting and Diwu, Zhenjun
Journal: Analytical biochemistry (2017): 44–48
Gene silencing of endothelial von Willebrand Factor attenuates angiotensin II-induced endothelin-1 expression in porcine aortic endothelial cells
Authors: Dushpanova, Anar and Agostini, Silvia and Ciofini, Enrica and Cabiati, Manuela and Casieri, Valentina and Matteucci, Marco and Del Ry, Silvia and Clerico, Aldo and Berti, Sergio and Lionetti, Vincenzo
Journal: Scientific Reports (2016)
Referencias
Imaging of nucleolar RNA in living cells using a highly photostable deep-red fluorescent probe
Authors: Zhou B, Liu W, Zhang H, Wu J, Liu S, Xu H, Wang P.
Journal: Biosens Bioelectron (2015): 189
RNA and DNA binding of inert oligonuclear ruthenium(II) complexes in live eukaryotic cells
Authors: Li X, Gorle AK, Ainsworth TD, Heimann K, Woodward CE, Collins JG, Keene FR.
Journal: Dalton Trans (2015): 3594
Low molecular weight fluorescent probes with good photostability for imaging RNA-rich nucleolus and RNA in cytoplasm in living cells
Authors: Song G, Sun Y, Liu Y, Wang X, Chen M, Miao F, Zhang W, Yu X, Jin J.
Journal: Biomaterials (2014): 2103
Luminescence of [Ru(bpy)2(dppz)]2+ bound to RNA mismatches
Authors: McConnell AJ, Song H, Barton JK.
Journal: Inorg Chem (2013): 10131
Co-aggregation of RNA binding proteins in ALS spinal motor neurons: evidence of a common pathogenic mechanism
Authors: Keller BA, Volkening K, Droppelmann CA, Ang LC, Rademakers R, Strong MJ.
Journal: Acta Neuropathol (2012): 733
Determination of RNA degradation by capillary electrophoresis with cyan light-emitted diode-induced fluorescence
Authors: Yang TH, Chang PL.
Journal: J Chromatogr A (2012): 78
Discrimination of DNA and RNA in cells by a vital fluorescent probe: lifetime imaging of SYTO13 in healthy and apoptotic cells
Authors: van Z, undefined and voort MA, de Grauw CJ, Gerritsen HC, Broers JL, oude Egbrink MG, Ramaekers FC, Slaaf DW.
Journal: Cytometry (2002): 226
Involvement of RNA and DNA in the staining of Escherichia coli by SYTO 13
Authors: Guindulain T, Vives-Rego J.
Journal: Lett Appl Microbiol (2002): 182
Neurotrophin-3 signals redistribute RNA in neurons
Authors: Knowles RB, Kosik KS.
Journal: Proc Natl Acad Sci U S A (1997): 14804
Translocation of RNA granules in living neurons
Authors: Knowles RB, Sabry JH, Martone ME, Deerinck TJ, Ellisman MH, Bassell GJ, Kosik KS.
Journal: J Neurosci (1996): 7812
Application Notes
A Novel Fluorescent Probe for Imaging and Detecting Hydroxyl Radical in Living Cells
A Novel Fluorescent Probe for Imaging and Detecting Hydroxyl Radical in Living Cells
A Comparison of Fluorescent Red Calcium Indicators for Detecting Intracellular Calcium Mobilization in CHO Cells
A Meta-Analysis of Common Calcium Indicators
A New Red Fluorescent & Robust Screen Quest™ Rhod-4™ Ca2+Indicator for Screening GPCR & Ca2+ Channel Targets
FAQ
RNS Detection: reactive nitrogen species probe selection guide
Are NADH and ROS related?
Are there any alternatives for ethidium bromide in agarose gels?
Are there any alternatives to Cy5?
Are there any calcium indicators that don’t require probenecid (PBC)?
AssayWire
Intracellular Nitric Oxide (NO) Assays
Intracellular Total ROS Activity Assays
Multicolor Intracellular Calcium Detection Probes
Nucleic Acid Quantification
Cal-520™ Calcium Indicators


