Kit de ensayo colorimétrico de acetilcolinesterasa, Amplite® Este kit proporciona un método conveniente para detectar la actividad de AChE.
Descripción
La acetilcolinesterasa, también conocida como AChE, es una enzima que degrada (a través de su actividad hidrolítica) el neurotransmisor acetilcolina, produciendo colina y un grupo acetato. Se encuentra principalmente en uniones neuromusculares y sinapsis colinérgicas en el sistema nervioso central, donde su actividad sirve para terminar la transmisión sináptica. AChE tiene una actividad catalítica muy alta: cada molécula de AChE degrada alrededor de 5000 moléculas de acetilcolina por segundo. Ensayo colorimétrico de acetilcolinesterasa Amplite®
La acetilcolinesterasa también se encuentra en las membranas de los glóbulos rojos, donde constituye el antígeno del grupo sanguíneo Yt. La acetilcolinesterasa existe en múltiples formas moleculares, que poseen propiedades catalíticas similares, pero difieren en su ensamblaje oligomérico y modo de unión a la superficie celular.
Este kit de ensayo colorimétrico de acetilcolinesterasa proporciona un método conveniente para detectar la actividad de AChE. El kit utiliza DTNB para cuantificar la tiolcolina producida a partir de la hidrólisis de acetiltiolcolina por AChE. La intensidad de absorción del aducto de DTNB es proporcional a la formación de tiolcolina y, por lo tanto, a la actividad de AChE.
Nombre en Ingles: Amplite® Colorimetric Acetylcholinesterase Assay Kit
| Catalogo | Producto | Presentación |
|---|---|---|
| AAT-11400 | Ensayo colorimétrico de acetilcolinesterasa Amplite® | 200 pruebas |
Importante: Solo para uso en investigación (RUO).
Plataforma
Lector de Microplacas de Absorbancia
| Absorbancia | 410 ± 5 nm |
| Placa recomendada | Fondo Claro |
Componentes
| Componente A: DTNB | 1 vial |
| Componente B: Buffer de ensayo | 1 botella (25 mL) |
| Componente C: Acetylthiocholine | 1 vial |
| Componente D: Acetylcholinesterase Standard | 1 vial (5 unidades) |
PREPARACION DE SOLUCIONES DE STOCK
A menos que se indique lo contrario, todas las soluciones madre no utilizadas deben dividirse en alícuotas de un solo uso y almacenarse a -20 °C después de la preparación. Evite los ciclos repetidos de congelación y descongelación.
- Solución madre de DTNB (20X):
Agregue 0,6 ml de buffer de ensayo (componente B) al vial de DTNB (componente A) para preparar una solución madre de DTNB 20X. Mantener alejado de la luz. Nota: DNTB no es fácil de disolver, es normal ver la turbidez de la solución. Se puede utilizar el sobrenadante o la mezcla para el experimento. - Solución madre de acetiltiocolina (20X):
Agregue 0,6 ml de ddH2O en el vial de acetiltiocolina (componente C) para preparar una solución madre de acetiltiocolina 20X. - Solución estándar de acetilcolinesterasa (50 U/mL):
Agregue 100 µl de ddH2O con BSA al 0,1 % en el vial de estándar de acetilcolinesterasa (componente D) para preparar una solución estándar de acetilcolinesterasa de 50 U/ml.
PREPARACION DE SOLUCION ESTANDAR
Estándar de acetilcolinesterasa
Para mayor comodidad, utilice el Planificador de dilución en serie: https://www.aatbio.com/tools/serial-dilution/11400
Agregue 20 µL de solución estándar de acetilcolinesterasa de 50 U/ml a 980 µL de buffer de ensayo (componente B) para generar una solución estándar de acetilcolinesterasa de 1000 mU/ml (AS7). Luego tome 1000 mU/mL de solución estándar de acetilcolinesterasa (AS7) y realice diluciones en serie 1:3 en buffer de ensayo (componente B) para obtener estándares de acetilcolinesterasa diluidos en serie (AS6 – AS1). Nota: La solución estándar de acetilcolinesterasa diluida es inestable y debe usarse dentro de las primeras 4 horas.
PREPARACION DE SOLUCION DE TRABAJO
Agregue 250 μl de solución madre de DTNB 20X y 250 μl de solución madre de acetiltiocolina 20X en 4,5 ml de buffer de ensayo (componente B) para obtener un volumen total de 5 ml de solución de trabajo de AChE. Mantener alejado de la luz.
Para una guia sobre la preparación de muestras de células, visite
https://www.aatbio.com/resources/guides/cell-sample-preparation.html
Imagenes

Figura 1. La respuesta a la dosis de acetilcolinesterasa se midió en una placa de 96 pocillos de fondo blanco/transparente con el kit de ensayo colorimétrico de acetilcolinesterasa Amplite® utilizando un lector de microplacas SpectraMax (Molecular devices). Se pueden detectar niveles tan bajos como 0,1 mU/pocillo de acetilcolinesterasa con 30 minutos de incubación (n=3).

Figura 2. Respuesta de Ca2+ de los reticulocitos a la estimulación con LPA. (A) Una imagen representativa de una nueva tinción de glóbulos rojos con azul de metileno de un ratón BALB/c después de la inducción de reticulocitosis. Las regiones coloreadas representan reticulocitos analizados en (B) y (C). Las puntas de flecha apuntan a glóbulos rojos lisados. (B) Imagen de RBC vivos cargados con Fluo-4. Las regiones coloreadas se transfieren desde (A). El círculo gris discontinuo marca un RBC que responde. (C) Trazas de intensidad para el contenido de Ca2+ de las células marcadas en (B) estimuladas con LPA. (D) Estadísticas de la respuesta máxima de reticulocitos y toda la población de glóbulos rojos sin reticulocitos (denominados eritrocitos) en condiciones de control y para estimulación con LPA de 5 µM. Los números debajo de los recuadros dan los números de celda tomados de tres ratones. (E) Actividad de AChE en reticulocitos y eritrocitos con y sin estimulación con LPA 5 µM durante 15 min. Las medidas comprenden un ensayo colorimétrico basado en 2×106 células por medida y los datos son el promedio de 5 ratones. *La actividad de acetilcolinesterasa (AChE) de 2 × 106 glóbulos rojos de cada población se realizó utilizando un kit de ensayo colorimétrico de AChE (Amplite, AAT Bioquest, EE. UU.) siguiendo las instrucciones del fabricante. Fuente: Gráfico de glóbulos rojos morfológicamente homogéneos que presentan una respuesta heterogénea a la estimulación hormonal por Jue Wang et al., PLOS, junio de 2013.
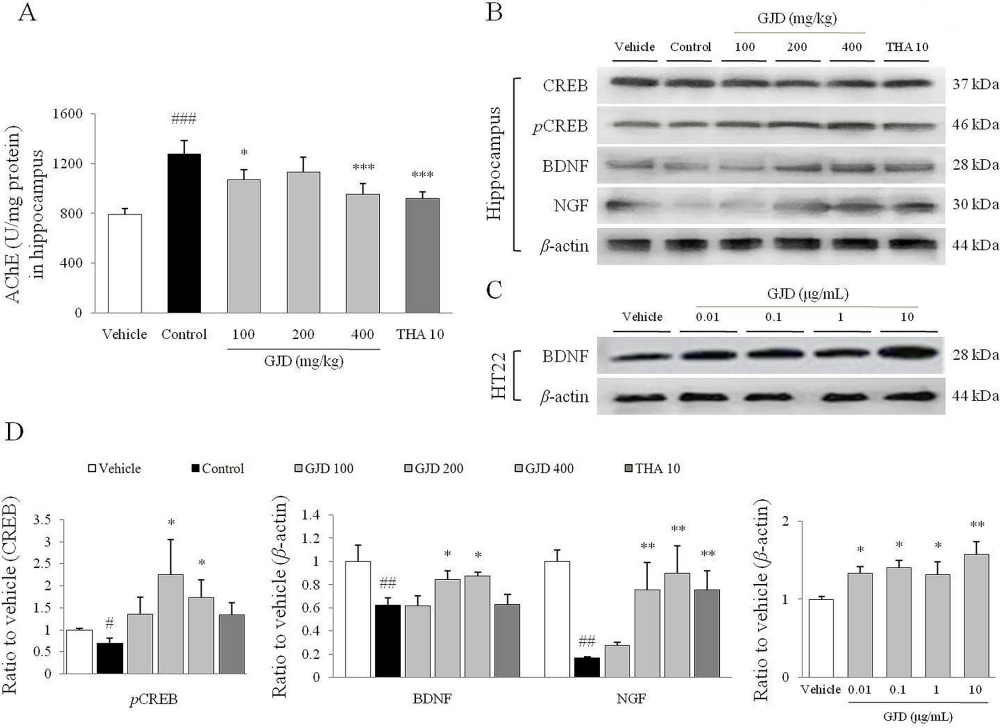
Figura 3. Niveles hipocampales de AChE, CREB y proteínas neurotróficas. La actividad de AChE (A) en el hipocampo se midió con un kit ELISA. Se mostró el ensayo de transferencia Western para los niveles de CREB, BDNF y NGF fosforilados en tejidos del hipocampo (B) y los niveles de BDNF en células HT22 (C) y sus intensidades relativas (D). Los datos se expresan como medias ± SD (n = 7 o 3). #P < 0,05, ##P < 0,01 y ###P < 0,001 en comparación con el grupo de vehículos; *P < 0,05, **P < 0,01 y ***P < 0,001 en comparación con el grupo de control. *La actividad de acetilcolinesterasa (AChE) en el hipocampo se determinó utilizando un kit de ensayo de actividad de AChE (AAT Bioquest; Sunnyvale, CA, EE. UU.) de acuerdo con el protocolo del fabricante. La absorbancia a 410 nm se midió usando un espectrofotómetro UV. Fuente: Gráfico de Gongjin-Dan Enhances Hippocampal Memory in a Mouse Model of Scopolamine-Induced Amnesia de Jin-Seok Lee et al., PLOS, agosto de 2016.
Productos
Ensayo de peroxidasa fluorimétrica (HRP) Amplite®Fluorescencia roja
Bibliografía
Ver todas las 59 bibliografias: Citation Explorer
Cell shape characteristics of human skeletal muscle cells as a predictor of myogenic competency: A new paradigm towards precision cell therapy
Authors: Desprez, Charlotte and Danovi, Davide and Knowles, Charles H and Day, Richard M
Journal: Journal of Tissue Engineering (2023): 20417314221139794
Amelioration of AlCl3-induced Memory Loss in the Rats by an Aqueous Extract of Guduchi, a Medhya Rasayana
Authors: Jamadagni, Shrirang B and Ghadge, Pooja M and Tambe, Mukul S and Srinivasan, Marimuthu and Prasad, Goli Penchala and Jamadagni, Pallavi S and Prasad, Shyam Baboo and Pawar, Sharad D and Gurav, Arun M and Gaidhani, Sudesh N and others,
Journal: Pharmacognosy Magazine (2023): 09731296221145063
Identification of Potent and Selective Acetylcholinesterase/Butyrylcholinesterase Inhibitors by Virtual Screening
Authors: Xu, Tuan and Li, Shuaizhang and Li, Andrew J and Zhao, Jinghua and Sakamuru, Srilatha and Huang, Wenwei and Xia, Menghang and Huang, Ruili
Journal: Journal of Chemical Information and Modeling (2023)
Synergistic protective effect of Beta vulgaris with meso-2, 3-dimercaptosuccinic acid against lead-induced neurotoxicity in male rats
Authors: Shaban, Nadia Z and Abd El-Kader, Sara E and Mogahed, Fayed AK and El-Kersh, Mohamed AL and Habashy, Noha H
Journal: Scientific Reports (2021): 1–18
Adlay hull extracts attenuate $\beta$-amyloid-induced neurotoxicity and oxidative stress in PC12 cells through antioxidative, anti-inflammatory, and antiapoptotic activities
Authors: Tsay, Gregory J and Lin, Yu-Ta and Hsu, Chia-Hong and Tang, Feng-Yao and Kuo, Yueh-Hsiung and Chao, Che-Yi
Journal: Biochemistry and Biophysics Reports (2021): 101020
Identification of Compounds for Butyrylcholinesterase Inhibition
Authors: Li, Shuaizhang and Li, Andrew J and Travers, Jameson and Xu, Tuan and Sakamuru, Srilatha and Klumpp-Thomas, Carleen and Huang, Ruili and Xia, Menghang
Journal: SLAS DISCOVERY: Advancing the Science of Drug Discovery (2021): 24725552211030897
Neuroprotective derivatives of tacrine that target NMDA receptor and acetyl cholinesterase-Design, synthesis and biological evaluation
Authors: Chandran, Remya and Vijayan, Dileep and Reddy, Eeda Koti and Kumar, Mantosh and Kesavan, Lakshmi and Jacob, Reena and Ayyiliyath, Sajith and Variyar, Jayadevi and Anwar, Shaik and Zhang, Kam and others,
Journal: bioRxiv (2021)
Bioorthogonally surface-edited extracellular vesicles based on metabolic glycoengineering for CD44-mediated targeting of inflammatory diseases
Authors: Lim, Gyeong Taek and You, Dong Gil and Han, Hwa Seung and Lee, Hansang and Shin, Sol and Oh, Byeong Hoon and Kumar, EK Pramod and Um, Wooram and Kim, Chan Ho and Han, Seungsu and others,
Journal: Journal of extracellular vesicles (2021): e12077
Profiling the Tox21 Chemical Collection for Acetylcholinesterase Inhibition
Authors: Li, Shuaizhang and Zhao, Jinghua and Huang, Ruili and Travers, Jameson and Klumpp-Thomas, Carleen and Yu, Wenbo and MacKerell Jr, Alexander D and Sakamuru, Srilatha and Ooka, Masato and Xue, Fengtian and others,
Journal: Environmental health perspectives (2021): 047008
Long-Term Tolerance Acquisition and Changes in Acetylcholinesterase Activity in Three Cladoceran Species After a 48-H Pulsed Exposure to Pirimicarb
Authors: Ishimota, Makoto and Tajiki-Nishino, Risako and Fukuyama, Tomoki and Tomiyama, Naruto and Sakamoto, Masaki and Ohyama, Kazutoshi
Journal: Water Air Soil Pollut (2020): 287
Referencias
Ver todas las 41 referencias: Citation Explorer
Expression and DNA microarray analysis of a platelet activating factor-related molecule in severe pneumonia in mice due to influenza virus and bacterial co-infection
Authors: Seki M, Kosai K, Hara A, Imamura Y, Nakamura S, Kurihara S, Izumikawa K, Kakeya H, Yamamoto Y, Yanagihara K, Miyazaki Y, Mukae H, Tashiro T, Kohno S.
Journal: Jpn J Infect Dis (2009): 6
Activation of the nitric oxide-cGMP pathway reduces phasic contractions in neonatal rat bladder strips via protein kinase G
Authors: Artim DE, Kullmann FA, Daugherty SL, Wu HY, de Groat WC.
Journal: Am J Physiol Renal Physiol (2009): F333
hChAT: a tool for the chemoenzymatic generation of potential acetyl/butyrylcholinesterase inhibitors
Authors: Green KD, Fridman M, Garneau-Tsodikova S.
Journal: Chembiochem (2009): 2191
Dietary high protein and vitamin C mitigates endosulfan toxicity in the spotted murrel, Channa punctatus (Bloch, 1793)
Authors: Sarma K, Pal AK, Sahu NP, Ayyappan S, Baruah K.
Journal: Sci Total Environ (2009): 3668
Physalin B inhibits Rhodnius prolixus hemocyte phagocytosis and microaggregation by the activation of endogenous PAF-acetyl hydrolase activities
Authors: Castro DP, Figueiredo MB, Genta FA, Ribeiro IM, Tomassini TC, Azambuja P, Garcia ES.
Journal: J Insect Physiol (2009): 532
Neuroprotective role of Convolvulus pluricaulis on aluminium induced neurotoxicity in rat brain
Authors: Bihaqi SW, Sharma M, Singh AP, Tiwari M.
Journal: J Ethnopharmacol (2009): 409
Synergistic activation of vascular TRPC6 channel by receptor and mechanical stimulation via phospholipase C/diacylglycerol and phospholipase A2/omega-hydroxylase/20-HETE pathways
Authors: Inoue R, Jensen LJ, Jian Z, Shi J, Hai L, Lurie AI, Henriksen FH, Salomonsson M, Morita H, Kawarabayashi Y, Mori M, Mori Y, Ito Y.
Journal: Circ Res (2009): 1399
Platelet activating factor (PAF) and activity of its biosynthetic and catabolic enzymes in blood and leukocytes of male patients with newly diagnosed heart failure
Authors: Detopoulou P, Nomikos T, Fragopoulou E, Antonopoulou S, Kotroyiannis I, Vassiliadou C, Panagiotakos DB, Chrysohoou C, Pitsavos C, Stefanadis C.
Journal: Clin Biochem (2009): 44
Protective effect of stilbenes containing extract-fraction from Cajanus cajan L. on Abeta(25-35)-induced cognitive deficits in mice
Authors: Ruan CJ, Si JY, Zhang L, Chen DH, Du GH, Su L.
Journal: Neurosci Lett (2009): 159
Platelet-activating factor acetylhydrolase and transacetylase activities in human aorta and mammary artery
Authors: Tsoukatos DC, Brocheriou I, Moussis V, Panopoulou CP, Christofidou ED, Koussissis S, Sismanidis S, Ninio E, Siminelakis S.
Journal: J Lipid Res (2008): 2240
Application Notes
A Library of Well-Defined and Water-Soluble Poly(alkyl phosphonate)s with Adjustable Hydrolysis
Acetylcholinesterase Inhibitory Activity of Pigment Echinochrome A
Ameliorative Effect of Novel Vitamin Formula with Herbal Extracts on Scopolamine-Induced Alzheimer’s Disease
Design of potent inhibitors of acetylcholinesterase using morin as the starting compound
Dietary and donepezil modulation of mTOR signaling and neuroinflammation in the brain
FAQ
Are coumarins water-soluble?
Are NADH and ROS related?
Can I measure NADPH without lysing my cells?
Can I use Amplite Fluorimetric Glutamic Acid Assay Kit with an absorbance microplate reader?
How are fatty acids activated?
AssayWire
Acetylcholinesterase Quantification
Acetylcholinesterase Assays
Glycerol 3-Phosphate Assays
Catalase Detection
Hydrogen Peroxide Detection


