Introducción Citómetria de flujo
La fluorescencia es una característica importante de los fluoróforos ya que se utiliza para diferenciar su color, es decir, la longitud de onda a la que emiten luz fluorescente. La capacidad de utilizar simultáneamente múltiples conjugados de fluoróforos con perfiles de emisión distintos y bien separados permite el análisis multiparamétrico, que es el verdadero poder de la citometría de flujo. Sin embargo, uno de los mayores desafíos en la citometría de flujo multiparamétrica es conocer la combinación correcta de fluoróforos a seleccionar para maximizar la sensibilidad del ensayo. Tenga en cuenta que con la combinación adecuada se pueden minimizar las compensaciones tediosas y los ajustes indirectos sin sacrificar la calidad y precisión de los datos recopilados. Entonces, ¿cómo se elige la combinación óptima de fluoróforos? La respuesta está dentro del instrumento.
¿Qué es un citómetro de flujo?
Esquemáticamente, el citómetro de flujo se compone de tres sistemas clave: el sistema fluídico, el óptico y el electrónico (Figura 1).
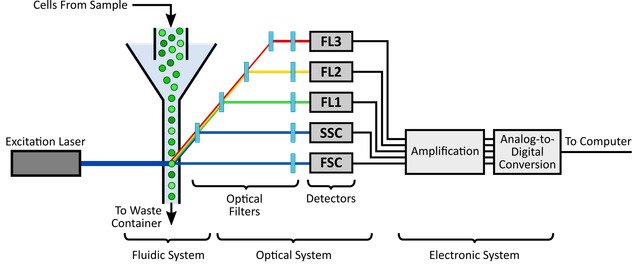
El sistema fluídico es responsable del transporte de las células. Pasa las células individualmente a través de líneas presurizadas que contienen líquido envolvente hasta el punto de interrogación donde el láser se cruza con la muestra. El caudal de muestra del sistema fluídico se puede manipular para mejorar el análisis. Por ejemplo, un caudal lento disminuye el tamaño del flujo de muestra, aumentando así la precisión y uniformidad de la detección de muestras.
El sistema óptico es responsable de la iluminación y la recolección de luz dentro del citómetro de flujo. Este sistema está compuesto por láseres de excitación, lentes y filtros. Los láseres garantizan que las células del punto de interrogación se exciten con luz uniforme de una longitud de onda específica. Por ejemplo, los láseres de argón emiten luz a una longitud de onda de 488 nm y se pueden usar para excitar fluoróforos con un máximo de absorción de 488 nm, como iFluor® 488 (Cat# 1023) y FITC (Cat# 135).
A medida que las células pasan a través del láser, éste emite fluorescencia y luz láser dispersa en todos los ángulos. Las “lentes y filtros” ópticas de recolección sirven para separar y dirigir las longitudes de onda específicas de la fluorescencia y la luz láser dispersa a los detectores apropiados. Estos detectores capturan la fluorescencia emitida y las luces láser dispersas, las convierten en fotocorriente y la pasan al sistema electrónico para su digitalización y procesamiento para su posterior análisis.
Desde su introducción en la década de 1970 hasta la actualidad, los citómetros de flujo han evolucionado significativamente. Los primeros diseños consistían en citómetros de un solo láser que sólo podían detectar el tamaño. Si bien los citómetros actuales cuentan con múltiples configuraciones de láser y filtro para facilitar el análisis multicolor, algunos citómetros son capaces de detectar hasta 14 parámetros simultáneamente. Por lo tanto, al elegir los fluoróforos apropiados para el análisis multicolor, se debe tener muy en cuenta la configuración del instrumento (más importante aún, los láseres y los filtros).
Elegir los fluoróforos correctos
Antes de elegir cualquier fluoróforo, considere lo siguiente: (1) el tipo de láser equipado en el citómetro de flujo, (2) la cantidad de láseres presentes, (3) las capacidades de excitación de cada láser y (4) cómo configurar filtros adecuadamente. El cuarto paso es fundamental para la sensibilidad del ensayo; configurar un filtro demasiado ancho puede provocar un exceso de ruido de fondo y resultados falsos.
Lo siguiente es seleccionar los fluoróforos apropiados. Los criterios a considerar al seleccionar fluoróforos para citometría de flujo multicolor incluyen:
• Fuerte fluorescencia caracterizada por un alto coeficiente de extinción y rendimiento cuántico.
• Máximos de excitación y emisión cuidadosamente adaptados a la configuración del filtro y del láser del instrumento.
• Perfil de emisión bien separado para minimizar la superposición y el desbordamiento espectral.
• El desplazamiento de Stokes grande es “crítico en el análisis de multiplexación, ya que cuanto mayor es el valor, mayor es la separación”.
Para obtener ayuda en la construcción de paneles de citometría de flujo multicolores, utilice el visor de espectro de fluorescencia de AAT Bioquest. Esta herramienta basada en web permite a los usuarios especificar la configuración del instrumento (por ejemplo, configuración del láser y del filtro) para verificar la compatibilidad con los fluoróforos. También se puede utilizar para determinar si dos fluoróforos tienen superposición espectral y si será necesaria una compensación (Figura 2).
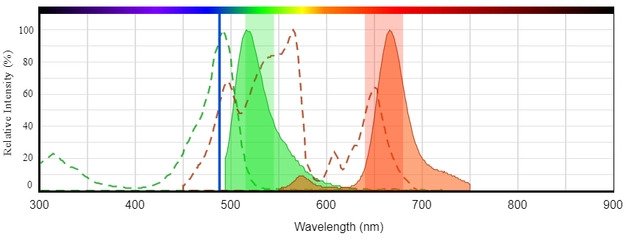
Espectro de excitación y emisión de iFluor® 488 (Cat# 1023, verde) y PE-Cy5 en tándem (Cat# 2610, rojo) que ilustra la clara separación espectral que permite el análisis multicolor. Tanto iFluor® 488 como PE-Cy5 pueden excitarse de manera eficiente con el láser de 488 nm.
El siguiente es un ejemplo de una combinación de fluoróforos para un panel de 6 colores, estos incluyen: iFluor™ 488 (Cat# 1023), PE (Cat# 2558), PE-Cy5.5 (Cat# 2613), PE-Cy7 (Cat# 2616), APC (Cat# 2554) o iFluor® 647 (Cat# 1031) y APC-Cy7 (Cat# 2625) (Tabla 1). Estos fluoróforos se conjugan posteriormente con un anticuerpo objetivo de elección y pueden utilizarse en FACS o inmunofenotipado. AAT Bioquest ofrece dos kits de conjugación de anticuerpos fáciles de usar, los kits ReadiLink™ y los kits Buccutite™, en una amplia gama de etiquetas fluorescentes, ficobiliproteínas y colorantes en tándem compatibles con cualquier configuración de citómetro de flujo. Además, AAT Bioquest ofrece una variedad de reactivos de alta calidad para citometría de flujo, algunos de los cuales, incluidos los protocolos, se destacan a continuación.
Tabla 1. Panel de citometría de flujo de seis coloresCat# Producto Ex (nm) Em (nm) Stokes Shift (nm) 1023 iFluor® 488 succinimidyl ester 491 518 27 2558 PE [R-Phycoerythrin] *CAS 11016-17-4* 565 575 10 2613 PE-Cy5.5 Tandem 565 700 135 2616 PE-Cy7 Tandem 565 780 215 2554 APC [Allophycocyanin] 651 662 11 1031 iFluor® 647 succinimidyl ester 649 664 15 2625 APC-Cy7 Tandem 651 780 129
| Cat# | Producto | Ex (nm) | Em (nm) | Stokes Shift (nm) |
| 1023 | iFluor® 488 succinimidyl ester | 491 | 518 | 27 |
| 2558 | PE [R-Phycoerythrin] *CAS 11016-17-4* | 565 | 575 | 10 |
| 2613 | PE-Cy5.5 Tandem | 565 | 700 | 135 |
| 2616 | PE-Cy7 Tandem | 565 | 780 | 215 |
| 2554 | APC [Allophycocyanin] | 651 | 662 | 11 |
| 1031 | iFluor® 647 succinimidyl ester | 649 | 664 | 15 |
| 2625 | APC-Cy7 Tandem | 651 | 780 | 129 |
Tinción intracelular y de superficie celular para citometría de flujo
La citometría de flujo es una técnica extremadamente útil que se puede utilizar para analizar diversos componentes intracelulares y de superficie celular. En la siguiente sección, analizamos los reactivos de citometría de flujo y los protocolos para la tinción intracelular y de superficie celular.
Biomarcadores de superficie celular de tinción
Los antígenos de superficie se expresan en la membrana de las células y, por tanto, son fácilmente accesibles. La mayoría de las aplicaciones de citometría de flujo se han centrado en la caracterización mediante antígenos de la superficie celular para definir subtipos de células y funciones utilizando anticuerpos marcados con fluorescencia. Debido a que estos antígenos de superficie son fácilmente accesibles para los anticuerpos, se pueden teñir fácilmente sin pasos de permeabilización. Una ventaja de explotar antígenos de superficie es que las células vivas pueden someterse a modelos de clasificación celular, como FACS, y usarse para aplicaciones posteriores.
Al teñir la superficie celular, considere lo siguiente:
• Prepare las células biológicas deseadas según el protocolo adecuado.
• Lavar las células con tampón PBS para eliminar el exceso de medio de cultivo celular.
• Reduzca las interacciones no específicas tratando las células con un agente bloqueador como suero bovino fetal al 1% o BSA.
• Después del bloqueo, tiñe los antígenos de la superficie celular con conjugados de anticuerpos marcados con fluorescencia.
• Lavar las células al menos dos veces con el tampón deseado.
• Vuelva a suspender las células en PBS helado y analícelas con un citómetro de flujo.

La Figura 3 que se muestra arriba ilustra la tinción de la superficie celular utilizando las consideraciones antes mencionadas. En este ejemplo, se marcaron células mononucleares de sangre periférica (PBMC) con el anticuerpo de superficie celular CD45 conjugado con ficoeritrina (PE). Las células se incubaron con Fc StainX (Biolegend) durante 20 minutos a temperatura ambiente para bloquear la interacción no específica. Después del bloqueo, las células se incubaron con conjugados CD45-PE durante 20 minutos en hielo, protegidas de la luz. Luego, las células se lavaron con tampón PBS, se resuspendieron en tampón de tinción y se analizaron utilizando un citómetro de flujo ACEA NovoCyte.
Tinción para objetivos intracelulares.
Los objetivos intracelulares también se pueden teñir y detectar mediante citometría de flujo. Sin embargo, dado que estos objetivos están ubicados dentro de las células, la tinción intracelular requiere pasos de fijación y permeabilización para permitir interacciones objetivo (por ejemplo, antígeno-anticuerpo). La fijación se puede lograr utilizando bajas concentraciones de formaldehído o alcohol, mientras que la permeabilización requiere tratar las células con detergentes como saponina, Triton-X-100 o disolventes orgánicos. Al teñir intracelularmente, también es importante considerar la ubicación del objetivo (por ejemplo, citosol o núcleo), ya que esto determinará qué protocolo y sistema de buffer es óptimo.
La Figura 4 que se muestra a la derecha ilustra la tinción intracelular utilizando conjugados secundarios de iFluor 488. En este ejemplo, las células Jurkat se fijaron con metanol al 100 % durante 30 minutos a -20 °C. Luego, las células se lavaron con tampón de lavado y se bloquearon usando PBST que contenía BSA al 1% durante 30 minutos a temperatura ambiente para reducir la unión no específica de los anticuerpos. Después del bloqueo, las células se incubaron con p-Akt o IgG de conejo durante 60 minutos a temperatura ambiente y luego se lavaron con tampón de lavado. A continuación, se agregaron anticuerpos secundarios anti-conejo de cabra iFluor 488 durante 30 minutos a temperatura ambiente, protegidos de la luz. Luego, las células se lavaron con buffer de lavado, se resuspendieron en buffer de tinción y se analizaron utilizando un citómetro de flujo ACEA NovoCyte.
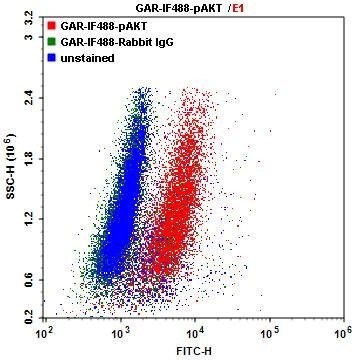
Gráfico de puntos de un solo parámetro de células Jurkat. Las células Jurkat se marcaron con anticuerpo p-AKT seguido de Goat Anti-Rabbit marcado con iF488 (5 µg/ml) para tinción intracelular. Las células marcadas se analizaron mediante un citómetro de flujo ACEA NovoCyte.
Seguimiento de la proliferación celular mediante citometría de flujo
Si bien la proliferación celular regulada promueve un crecimiento y desarrollo saludables, la desregulación del ciclo celular es una indicación distintiva de cáncer y enfermedades autoinmunes. El uso de métodos de alto rendimiento basados en fluorescencia, como la citometría de flujo, es particularmente útil para el estudio de la proliferación y la detección de nuevas terapias contra el cáncer. Al elegir un trazador de proliferación celular hay varios criterios a considerar: (1) el trazador de células no debe ser tóxico para las células, (2) el trazador de células debe mostrar una transferencia mínima de colorante entre células adyacentes y (3) el trazador de células debe exhiben fluorescencia brillante y estable en células marcadas.
Los tintes CytoTell (Figura 5) se crearon teniendo en cuenta los criterios antes mencionados. Al igual que CFSE, los colorantes CytoTell™ son indicadores permeables a las células que reaccionan con proteínas citoplasmáticas a través de residuos de lisina y otras fuentes de aminas, produciendo proteínas altamente fluorescentes e impermeables a las células. El enlace covalente resultante garantiza que los tintes CytoTell™ no se transfieran a células adyacentes y se retengan bien en las células durante varias generaciones. A medida que las células se dividen, las proteínas fluorescentes CytoTell™ se distribuyen equitativamente entre las células hijas durante la división celular, y cada nueva generación de células está marcada por una intensidad de fluorescencia la mitad de la de sus padres, que es fácilmente detectable mediante citometría de flujo.
En comparación con CFSE, los tintes CytoTell™ tienen una citotoxicidad mínima y una mejor retención celular. Los tintes CytoTell™, distintos de CytoTell™ Green, son excelentes para aplicaciones multicolores con líneas celulares GFP o anticuerpos marcados con iFluor 488™.

Ensayo de seguimiento celular con CytoTell™ Green. Se sembraron células Jurkat (2 x 106) y se tiñeron con tintes CytoTell™ Green el día 0. Las células se pasaron en serie en una proporción de 1:1 y se pasaron durante 9 días. La intensidad de la fluorescencia se midió utilizando el citómetro de flujo NovoCyte de ACEA Biosciences, Inc. Las generaciones sucesivas se representaron con diferentes colores.
Información de Producto
Tabla 3. Kits de etiquetado de anticuerpos ReadiLink™ Rapid iFluor®Kits de etiquetado de anticuerpos ReadiLink™ Equivalente de fluoróforo Ex/Em (nm) Imaging Citómetria de Flujo Cat No. ReadiLink™ Rapid iFluor® 350 AMCA, Alexa Fluor® 350 344/448 Yes 1220 ReadiLink™ xtra Rapid iFluor® 350 AMCA, Alexa Fluor® 350 344/448 Yes 1950 ReadiLink™ Rapid iFluor® 488 FITC, Alexa Fluor® 488 491/516 Yes Yes 1255 ReadiLink™ xtra Rapid iFluor® 488 FITC, Alexa Fluor® 488 491/516 Yes Yes 1955 ReadiLink™ Rapid iFluor® 555 Cy3, Alexa Fluor® 555 556/569 Yes 1227 ReadiLink™ xtra Rapid iFluor® 555 Cy3, Alexa Fluor® 555 556/569 Yes 1958 ReadiLink™ Rapid iFluor® 594 Texas Red®, Alexa Fluor® 594 587/603 Yes 1230 ReadiLink™ xtra Rapid iFluor® 594 Texas Red®, Alexa Fluor® 594 587/603 Yes 1960 ReadiLink™ Rapid iFluor® 633 Cy5, Alexa Fluor® 633 638/655 Yes Yes 1260 ReadiLink™ Rapid iFluor® 647 Cy5, Alexa Fluor® 647 654/669 Yes Yes 1235 ReadiLink™ xtra Rapid iFluor® 647 Cy5, Alexa Fluor® 647 654/669 Yes Yes 1963 ReadiLink™ Rapid iFluor® 680 Cy5.5, Alexa Fluor® 680, IRDye® 700 682/701 Yes Yes 1240 ReadiLink™ Rapid iFluor® 700 Alexa Fluor® 700 693/713 Yes Yes 1245 ReadiLink™ Rapid iFluor® 750 Cy7, Alexa Fluor® 750 759/777 Yes 1250 ReadiLink™ xtra Rapid iFluor® 750 Cy7, Alexa Fluor® 750 759/777 Yes 1965 ReadiLink™ Rapid iFluor® 790 IRDye® 800, Alexa Fluor® 790 782/811 Yes Yes 1265
| Kits de etiquetado de anticuerpos ReadiLink™ | Equivalente de fluoróforo | Ex/Em (nm) | Imaging | Citómetria de Flujo | Cat No. |
| ReadiLink™ Rapid iFluor® 350 | AMCA, Alexa Fluor® 350 | 344/448 | Yes | 1220 | |
| ReadiLink™ xtra Rapid iFluor® 350 | AMCA, Alexa Fluor® 350 | 344/448 | Yes | 1950 | |
| ReadiLink™ Rapid iFluor® 488 | FITC, Alexa Fluor® 488 | 491/516 | Yes | Yes | 1255 |
| ReadiLink™ xtra Rapid iFluor® 488 | FITC, Alexa Fluor® 488 | 491/516 | Yes | Yes | 1955 |
| ReadiLink™ Rapid iFluor® 555 | Cy3, Alexa Fluor® 555 | 556/569 | Yes | 1227 | |
| ReadiLink™ xtra Rapid iFluor® 555 | Cy3, Alexa Fluor® 555 | 556/569 | Yes | 1958 | |
| ReadiLink™ Rapid iFluor® 594 | Texas Red®, Alexa Fluor® 594 | 587/603 | Yes | 1230 | |
| ReadiLink™ xtra Rapid iFluor® 594 | Texas Red®, Alexa Fluor® 594 | 587/603 | Yes | 1960 | |
| ReadiLink™ Rapid iFluor® 633 | Cy5, Alexa Fluor® 633 | 638/655 | Yes | Yes | 1260 |
| ReadiLink™ Rapid iFluor® 647 | Cy5, Alexa Fluor® 647 | 654/669 | Yes | Yes | 1235 |
| ReadiLink™ xtra Rapid iFluor® 647 | Cy5, Alexa Fluor® 647 | 654/669 | Yes | Yes | 1963 |
| ReadiLink™ Rapid iFluor® 680 | Cy5.5, Alexa Fluor® 680, IRDye® 700 | 682/701 | Yes | Yes | 1240 |
| ReadiLink™ Rapid iFluor® 700 | Alexa Fluor® 700 | 693/713 | Yes | Yes | 1245 |
| ReadiLink™ Rapid iFluor® 750 | Cy7, Alexa Fluor® 750 | 759/777 | Yes | 1250 | |
| ReadiLink™ xtra Rapid iFluor® 750 | Cy7, Alexa Fluor® 750 | 759/777 | Yes | 1965 | |
| ReadiLink™ Rapid iFluor® 790 | IRDye® 800, Alexa Fluor® 790 | 782/811 | Yes | Yes | 1265 |
Referencias
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y. & Nalbant, A. Flow cytometry: basic principles and applications. Critical Rev. Biotechnol. 37, 163″176.
- Davies D. (2010). Cell sorting by flow cytometry. In: Macey MG, ed. Flow cytometry: principles and applications. Totowa (NJ): Humana Press, 257″76
- Macey MG. (2010). Principles of flow cytometry. Flow cytometry: principles and applications In: Macey MG, ed. Totowa (NJ): Humana Press, 1″15
- Wlodkowic D, Skommer J, Darzynkiewicz Z. (2009). Flow cytometry-based apoptosis detection. Methods Mol Biol, 559, 19″32
- Errante, Paolo. (2016). Flow cytometry: a literature review. 10.13140/RG.2.1.2461.0969
- Laerum, O. D. and Farsund, T. (1981), Clinical application of flow cytometry: A review. Cytometry, 2: 1-13. doi:10.1002/cyto.990020102
- Wood, J.C.S. and Hoffman, R.A. (1998) Evaluating fluorescence sensitivity on flow cytometers: an overview. Cytometry, 33: 256-259.
- Van Dilla, M.A., Dean, P.N., Laerum, O.D. and Melamed, M.R. (eds.) (1985). Flow cytometry instrumentation and data analysis. Academic Press, Orlando.
- Wood, J.C.S. (1993). Clinical Flow Cytometry Instrumentation. In: Clinical Flow Cytometry. Principles and Applications. (eds. Bauer, K.D, Duque, R.E. and Shankey, T.V.), pp. 71-92. Williams and Wilkins, Baltimore.
